Kaedah analisis konduktometri ialah pengukuran kekonduksian elektrolitik untuk memantau kemajuan tindak balas kimia. Sains ini digunakan secara meluas dalam kimia analitik, di mana pentitratan adalah kaedah operasi standard. Apakah konduktometri? Dalam amalan biasa dalam kimia analitik, istilah ini digunakan sebagai sinonim untuk pentitratan, sementara ia juga digunakan untuk menerangkan aplikasi bukan pentitratan. Apakah faedah menggunakan kaedah analisis ini? Ia sering digunakan untuk menentukan kekonduksian keseluruhan larutan atau untuk menganalisis titik akhir pentitratan yang melibatkan ion.
Sejarah
Pengukuran konduktif bermula seawal abad ke-18, apabila Andreas Baumgartner menyedari bahawa garam dan air mineral dari Bad Gastein berada diAustria mengalirkan elektrik. Oleh itu, penggunaan kaedah ini untuk menentukan ketulenan air, yang sering digunakan hari ini untuk menguji keberkesanan sistem pembersihan air, bermula pada tahun 1776. Maka bermulalah sejarah kaedah analisis konduktometrik.
Friedrich Kohlrausch meneruskan pembangunan sains ini pada tahun 1860-an, apabila beliau menggunakan arus ulang alik pada air, asid dan larutan lain. Pada masa ini, Willis Whitney, yang sedang mengkaji interaksi asid sulfurik dan kompleks kromium sulfat, menemui titik akhir konduktometrik yang pertama. Penemuan ini memuncak dalam pentitratan potensiometri dan instrumen pertama untuk analisis volumetrik oleh Robert Behrend pada tahun 1883 dalam pentitratan klorida dan bromida HgNO3. Oleh itu, kaedah analisis konduktometri moden adalah berdasarkan Behrend.
Perkembangan ini memungkinkan untuk menguji keterlarutan garam dan kepekatan ion hidrogen, serta titrasi asid-bes dan redoks. Kaedah analisis konduktometri telah ditambah baik dengan pembangunan elektrod kaca, yang bermula pada tahun 1909.
Pentitratan
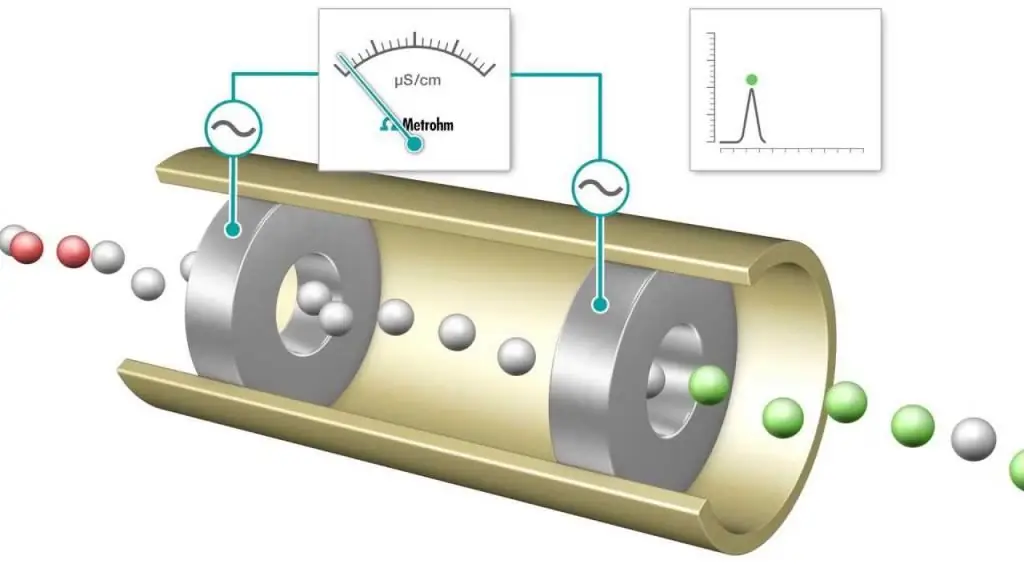
Pentitratan konduktometri ialah pengukuran di mana kekonduksian elektrolitik bagi campuran tindak balas dipantau secara berterusan dengan menambahkan satu reagen. Titik kesetaraan ialah titik di mana kekonduksian tiba-tiba berubah. Peningkatan atau penurunan yang ketara dalam kekonduksian dikaitkan dengan perubahan dalam kepekatan dua ion yang paling konduktif, hidrogen dan ion hidroksida. Kaedah iniboleh digunakan untuk mentitrasi larutan berwarna atau ampaian homogen (cth. ampaian pulpa kayu) yang tidak boleh digunakan dengan penunjuk konvensional.
Pentitratan asid-bes dan redoks sering dilakukan, yang menggunakan penunjuk biasa untuk menentukan titik akhir, seperti metil jingga, fenolftalein untuk titrasi asid-bes dan larutan kanji untuk proses redoks jenis iodometrik. Walau bagaimanapun, ukuran kekonduksian elektrik juga boleh digunakan sebagai alat untuk menentukan titik akhir, contohnya apabila memerhati larutan HCl dengan bes kuat NaOH.
Penutralan Proton
Apabila pentitratan berlangsung, proton dinetralkan untuk membentuk NaOH dengan membentuk air. Bagi setiap jumlah NaOH yang ditambahkan, bilangan ion hidrogen yang setara dikeluarkan. Sebenarnya, kation H+ mudah alih digantikan dengan ion Na+ yang kurang mudah alih, dan kekonduksian larutan yang dititrasi, serta kekonduksian sel yang diukur, berkurangan. Ini berterusan sehingga titik kesetaraan dicapai di mana larutan natrium klorida NaCl boleh diperolehi. Jika lebih banyak bes ditambah, terdapat peningkatan apabila lebih banyak ion Na+ dan OH- ditambah dan tindak balas peneutralan tidak lagi menghilangkan jumlah H+ yang ketara.

Akibatnya, apabila asid kuat dititrasi dengan bes kuat, kekonduksian mempunyai minimum pada titik kesetaraan. Minimum iniboleh digunakan sebagai ganti pewarna penunjuk untuk menentukan titik akhir pentitratan. Keluk pentitratan ialah graf nilai kekonduksian atau kekonduksian yang diukur sebagai fungsi isipadu larutan NaOH yang ditambah. Keluk pentitratan boleh digunakan untuk menentukan titik kesetaraan secara grafik. Kaedah analisis konduktometri (dan penggunaannya) amat relevan dalam kimia moden.
Reaksi
Untuk tindak balas antara asid lemah-bes lemah, kekonduksian elektrik mula-mula agak berkurangan, kerana beberapa ion H+ yang tersedia digunakan. Kemudian kekonduksian meningkat sedikit sehingga isipadu titik kesetaraan disebabkan oleh sumbangan kation garam dan anion (sumbangan ini dalam kes bes berasid kuat diabaikan dan tidak dianggap di sana.) Selepas titik kesetaraan dicapai, kekonduksian meningkat dengan cepat disebabkan oleh lebihan ion OH.
Pengesan kekonduksian (kaedah analisis konduktometri) juga digunakan untuk mengukur kepekatan elektrolit dalam larutan akueus. Kepekatan molar analit yang mencipta kekonduksian larutan boleh didapati daripada rintangan elektrik larutan yang diukur.
Kaedah analisis konduktometrik: prinsip dan formula
(2.4.13) C=Constcell1Λm1Res, dengan Constcell ialah nilai malar bergantung pada sel pengukur, Res ialah rintangan elektrik yang diukur oleh peranti (mengikut hukum Ohm Res=I / V, dan dengan pemalar voltan V pengukuran I intensiti membolehkan anda mengira Res), dan Λm adalah setarakekonduksian untuk zarah ionik. Walaupun untuk tujuan praktikal Λm boleh dianggap malar, ia bergantung kepada kepekatan mengikut hukum Kohlrausch:
(2.4.14)=Хт Λm0-ΘC, dengan Θ ialah pemalar, dan Λm0 ialah ciri kekonduksian molar mengehadkan setiap ion. Kekonduksian molar pula bergantung pada suhu.
Skrip
Pembangunan kaedah analisis pengukuran konduktometri telah membawa saintis kepada penemuan baharu. Para saintis menentukan nisbah supersaturasi kritikal, Scrit, menggunakan konduktometri dalam sistem pemendakan AgCl homogen yang melebihi ion Ag+, menggunakan hidrolisis alkil klorida sebagai sumber ion CI." Mereka mendapati Scrit=1.51, 1.73 dan 1.85 masing-masing pada 15, 25 dan 35°C, di mana S=([Ag+][Cl-] / Ksp) 1/2 mengikut takrifannya. Jika takrifan faktor supersaturasi ini ditukar kepada kita (S=[Ag+][Cl-] / Ksp), keputusannya ialah 2.28, 2.99 dan 3.42, masing-masing, dalam persetujuan yang agak baik dengan keputusan kajian ini. Walau bagaimanapun, pergantungan suhu Scrit adalah bertentangan dengan yang diterangkan dalam kajian ini. Walaupun sebab percanggahan ini tidak jelas, penurunan Scrit dengan peningkatan suhu mungkin agak munasabah, kerana kadar nukleasi berubah secara mendadak dengan perubahan kecil dalam ΔGm/ kT, dan oleh itu ΔGm/ kT, yang berkadar dengan T − 3 (lnSm) 2 mengikut formula (1.4.12) dianggap hampir malar dengan perubahan suhu dalam sistem yang diberikan. Secara kebetulan, takrifan S mestilah [Ag +] [Cl -] / Ksp, kerana nisbah supersaturasi dari segiKepekatan monomer [AgCl] pada mulanya diberikan sebagai S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp.
Tanaka dan Iwasaki
Sejarah kaedah analisis konduktometri diteruskan oleh dua saintis ikonik Jepun. Tanaka dan Iwasaki mengkaji proses nukleasi zarah AgCl dan AgBr menggunakan kaedah aliran terhenti dalam kombinasi dengan spektrofotometer berbilang saluran, yang berguna untuk mengkaji proses pantas pada susunan msec. Mereka mendapati bahawa beberapa kompleks perak halida AgXm (m-1) tertentu, mempunyai jalur penyerapan UV yang agak sempit, terbentuk serta-merta apabila larutan AgC104 tertib 10-4 mol dm-3 dicampur dengan KX (X=Cl atau Br) larutan tertib dari 10-2 hingga 10-1 mol dm-3 diikuti dengan pereputan pantasnya kira-kira 10 ms dengan pembentukan produk perantaraan yang mempunyai penyerapan UV yang luas dan perubahan spektrum yang lebih perlahan. daripada produk perantaraan. Mereka mentafsirkan perantaraan sebagai teras monodisperse (AgX) n yang terdiri daripada n molekul dan menentukan n daripada nisbah ketara -dC/dt α Cn pada t=0 untuk pelbagai kepekatan awal C prekursor AgXm (m-1) - (n=7 -10 untuk AgCl, n=3-4 untuk AgBr).

Walau bagaimanapun, oleh kerana prekursor AgXm (m − 1) mereput secara tidak pegun, teori penukleasian separa pegun tidak digunakan dalam proses ini, dan dengan itu nilai n yang terhasil tidak sepadan dengan nnilai nukleus kritikal. Jika hasil perantaraan mengandungi nukleus monodisperse,dibentuk oleh kompleks monomerik, nisbah -dC/dt α C mungkin tidak dikekalkan. Melainkan jika kita mengandaikan bahawa kelompok yang lebih kecil daripada n-mers berada dalam keseimbangan, ki − 1, ici − 1c1=ki, i − 1ci, antara satu sama lain dalam tindak balas berjujukan c1 → c2 → c3 →… → cn − 1 → cn., dan hanya langkah terakhir cn − 1 → cn tidak boleh diterbalikkan; iaitu c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
Selain itu, perlu diandaikan bahawa kepekatan kelompok dari 2 hingga n-1 mempunyai kepekatan keseimbangan yang boleh diabaikan. Walau bagaimanapun, nampaknya tiada asas untuk membenarkan andaian ini. Sebaliknya, kami cuba mengira jejari nukleus kritikal dan pekali supersaturasi S pada penghujung proses pantas, menggunakan γ=101 mJ m − 2 untuk AgCl19 padu dan γ=109 mJ m − 2 untuk AgBr20 padu, dengan mengandaikan bahawa nilai n, 7-10 untuk AgCl19 dan 3-4 untuk AgBr20, adalah bersamaan dengan saiz nukleus monodisperse, n. Kaedah analisis konduktometrik, ulasan yang terdiri daripada sekadar meluluskan kepada mengagumi, melahirkan kimia baru sebagai sains.
Hasilnya, saintis menemui formula berikut: r=0.451 nm dan S=105 untuk AgCl dengan n=9; r=0.358 nm dan S=1230 untuk AgBr dengan n=4. Memandangkan sistem mereka adalah setanding dengan sistem Davis dan Jones, yang memperoleh supertepu kritikal AgCl kira-kira 1.7-2.0 pada 25 °C. Menggunakan konduktometri bancuhan terus dalam jumlah yang sama bagi larutan akueus cair AgNO3 dan KCl, nilai S yang sangat tinggi mungkin tidak mencerminkan faktor supertepu sebenar.dalam keseimbangan dengan nukleus perantaraan.
penyerapan UV
Nampaknya lebih munasabah untuk mengaitkan perantaraan dengan penyerapan UV yang luas kepada nukleus yang jauh lebih besar daripada purata dengan taburan saiz lebar yang dijana oleh tindak balas jujukan tidak pegun. Perubahan perlahan nukleus perantaraan seterusnya nampaknya berkaitan dengan kematangannya di Ostwald.

Dalam konteks di atas, ahli kimia Amerika Nielsen juga memperoleh nyang serupa sekitar 12 dan S sepadan lebih besar daripada 103 untuk nukleasi zarah barium sulfat daripada ukuran kekeruhan sebagai fungsi supersaturasi, menggunakan n=dlogJ / dlogC dalam teori seperti Becher-Dering kepada formula. (1.3.37), tetapi memberi (n+ 1) bukannya n. Memandangkan larutan ion barium dan ion sulfat dicampur secara langsung dalam eksperimen ini, nukleasi sementara pantas sepatutnya berakhir serta-merta selepas pencampuran, dan apa yang diukur boleh menjadi kadar kematangan Ostwald berikutnya yang perlahan dan/atau gabungan nukleus yang dijana. Nampaknya, ini adalah sebab nilai n yang tidak munasabah dan supersaturasi yang sangat tinggi. Oleh itu, kita mesti sekali lagi ambil perhatian bahawa beberapa takungan spesies monomerik yang melepaskannya sebagai tindak balas kepada penggunaannya sentiasa diperlukan untuk mencapai nukleasi separa pegun dalam sistem tertutup. Semua teori klasik nukleasi, termasuk teori Becher-Döring, secara tersirat menganggap keadaan sedemikian. Definisi konduktometrikkaedah analisis diberikan dalam bahagian artikel di atas.
Saintis lain telah menyiasat proses nukleasi sementara bagi halida perak dengan radiolisis berdenyut air yang mengandungi metilena halida dan ion perak, di mana metilena halida diuraikan untuk membebaskan ion halida oleh elektron terhidrat yang dihasilkan oleh sinaran berdenyut dalam julat dari 4 ns hingga 3 μs. Spektrum produk telah dirakam menggunakan photomultiplier dan kamera coretan dan prekursor halida perak monomerik didapati terbentuk dari semasa ke semasa mengikut urutan mikrosaat diikuti oleh proses nukleasi yang serupa dengan yang diperhatikan oleh Tanaka dan Iwasaki. Keputusan mereka jelas menunjukkan bahawa proses nukleasi halida perak dengan pencampuran langsung bahan tindak balas terdiri daripada dua langkah asas; iaitu pembentukan prekursor monomerik susunan μs dan peralihan seterusnya kepada nukleus urutan 10 ms. Perlu diingat bahawa saiz purata nukleus adalah kira-kira 10 nm.
Tepu
Mengenai pekali supertepu untuk nukleasi zarah AgCl dalam sistem terbuka di mana kepekatan tinggi bahan tindak balas seperti AgNO3 dan KCl dimasukkan secara berterusan ke dalam larutan gelatin sepanjang pemendakan, Strong dan Wey31 melaporkan 1.029 (80° C) - 1.260 (40°C) dan Leubner32 melaporkan 1.024 pada 60°C seperti yang dianggarkan daripada mengukur kadar pertumbuhan zarah benih AgCl pada supertepu kritikal. Ini adalah intipati kaedah konduktometri analisis kuantitatif.
Sebaliknya, untuk sistem zarah AgBr terbuka, beberapanilai anggaran pekali supersaturasi kritikal, Scrit: Scrit∼- 1.5 pada 70 °C mengikut Wey dan Strong33 daripada kadar pertumbuhan maksimum bergantung saiz yang ditentukan dengan mencari ambang renukleasi pada kadar yang berbeza untuk menambahkan larutan AgNO3 pada KBr penyelesaian dengan kehadiran zarah benih oleh jet berganda; Scrit=1.2-1.5 pada 25°C mengikut Jagannathan dan Wey34 sebagai faktor supersaturasi maksimum yang ditentukan daripada persamaan Gibbs-Thomson dengan data mereka mengenai saiz purata minimum nukleus yang diperhatikan oleh mikroskop elektron semasa langkah penukleasian pemendakan AgBr dua jet. Ini sangat berkesan apabila menggunakan kaedah pengkuantitian konduktometri.

Apabila mengira nilai Scrit ini, mereka mengambil γ=140 mJ m − 2. Memandangkan nukleasi dalam sistem terbuka sepadan dengan proses kemandirian nukleus yang baru lahir yang dicipta di zon tempatan dengan supertepu yang sangat tinggi berhampiran saluran keluar bahan tindak balas, kritikal supersaturasi sepadan dengan kepekatan zat terlarut dalam keseimbangan dengan nukleus saiz maksimum, jika kita menggunakan data Sugimoto35 pada jejari maksimum nukleus AgBr dalam sistem terbuka (.3 8.3 nm) dengan γ teori untuk AgBr padu (=109 mJ m − 2) 3, maka faktor supersaturasi kritikal, Scrit, dikira sebagai 1.36 pada 25°C (jika γ diandaikan sebagai 140 mJ/m2, maka Scrit=1.48).
Akibatnya, dalam apa jua keadaan, supersaturasi kritikal masuksistem terbuka zarah halida perak biasanya jauh di bawah supersaturasi maksimum (mungkin hampir dengan supersaturasi kritikal) dalam sistem tertutup. Ini kerana jejari purata nukleus yang dijana dalam zon tempatan sistem terbuka adalah lebih besar daripada rmdalam sistem tertutup, mungkin disebabkan oleh gabungan serta-merta nukleus primer yang sangat pekat dalam zon tempatan sistem terbuka dengan tinggi. kepekatan elektrolit tempatan.
Permohonan
Penggunaan kaedah pentitratan konduktometri untuk rakaman berterusan semasa proses enzimatik telah dikaji dan dianalisis secara meluas. Hampir semua kaedah analisis elektrokimia adalah berdasarkan tindak balas elektrokimia (potensiometri, voltammetri, amperometri, koulometri).
Kaedah analisis konduktometri ialah kaedah yang sama ada tiada tindak balas elektrokimia pada elektrod sama sekali, atau terdapat tindak balas sekunder yang boleh diabaikan. Oleh itu, dalam kaedah ini, sifat paling penting bagi larutan elektrolit dalam lapisan sempadan ialah kekonduksian elektriknya, yang berbeza-beza mengikut julat tindak balas biologi yang agak luas.
Faedah
Biosensor konduktometri juga mempunyai beberapa kelebihan berbanding jenis transduser lain. Pertama, ia boleh dibuat menggunakan teknologi standard filem nipis kos rendah. Ini, bersama-sama dengan penggunaan kaedah yang dioptimumkan untuk melumpuhkan bahan biologi, membawa kepada pengurangan ketara dalam kedua-dua kos utama peranti danjumlah kos analisis. Untuk mikrobiosensor terbina dalam, adalah mudah untuk melakukan mod pengukuran pembezaan, yang mengimbangi pengaruh luaran dan meningkatkan ketepatan pengukuran dengan ketara.
Data dengan jelas menunjukkan potensi besar biosensor konduktometri. Walau bagaimanapun, ini masih merupakan trend yang agak baharu dalam biosensor, jadi pembangunan peranti komersial mempunyai masa depan yang menjanjikan.
Kaedah baharu
Sesetengah saintis telah menerangkan kaedah umum untuk mengukur pKa dengan konduktans. Kaedah ini digunakan secara meluas sehingga kira-kira tahun 1932 (sebelum kaedah pengukuran pH digunakan). Kaedah konduktometri sangat sensitif kepada suhu dan tidak boleh digunakan untuk mengukur nilai pKa yang bertindih. Kelebihan yang mungkin untuk sampel tanpa kromofor ialah ia boleh digunakan dalam larutan yang sangat cair, sehingga 2.8 × 10-5 M. Dalam beberapa tahun kebelakangan ini, konduktometri 87 telah digunakan untuk mengukur pKa lidokain, walaupun keputusan yang diperoleh ialah 0.7 seunit di bawah nilai pH yang diterima umum.

Albert dan Sarjan juga menerangkan kaedah untuk menentukan pKa daripada ukuran keterlarutan. Seperti yang dinyatakan di atas, keterlarutan bergantung kepada pKa, jadi jika keterlarutan diukur pada nilai pH berbilang pada lengkung, pKa boleh ditentukan. Peck dan Benet menerangkan kaedah umum untuk menganggar nilai pKa untuk bahan monoprotik, diprotik, dan amfoterik diberikan satu set keterlarutan dan ukuran pH. Hansen dan Hafliger memperoleh pKa sampel, yangcepat terurai melalui hidrolisis daripada kadar pelarutan awalnya sebagai fungsi pH dalam peranti cakera berputar. Hasilnya sepadan dengan keputusan pH/UV, tetapi penguraian menjadikan kaedah yang terakhir sukar. Ini, pada umumnya, penerangan kaedah analisis konduktometri.






